El tracto respiratorio se extiende desde las fosas nasales hasta los alvéolos pulmonares, está
habitado por diversas comunidades bacterianas.
Basándonos en la secuencia del gen 16SrRNA, los estreptococos se clasifican en 5 grandes grupos:
piógeno, mitis, angiosus, salivarus y bovis
Grupo piógeno
En el grupo piogénico, basándonos en el tamaño grande de la colonia, en la reacción hemolítica en
placas de sangre y en la detección de antígeno de grupo de Lancefield, es fácil identificar los e
streptococos betahemolíticos más comunes: S. pyogenes (grupo A) y S. agalactiae (grupo B)
S. pyogenes
S. pyogenes no presenta grandes problemas en su identificación. Se trata de colonias betahemolíticas,
que generalmente son sensibles a la bacitracina. S. pyogenes. Inhalación de partículas de enfermos y
portadores (humanos, perros y otros animales de compañía). Se diseminan por tos, estornudos, comida
y bebida contaminadas. Algunas cepas de S. pyogenes pueden estar infectadas con fagos (producen
toxina speA ) y producir fiebre escarlatina.
S. agalactiae
Existen varios medios de cultivo selectivos para la detección de S. agalactiae, recomendados para el
cribado de colonización por estreptococos del grupo B en mujeres embarazadas. El medio Granada 8 es
de interpretación sencilla y tiene una sensibilidad y especificidad elevadas. Se basa en la detección del
pigmento carotenoide que expresa la mayoría de los estreptococos de este grupo. El crecimiento de
colonias de color naranja, tras incubación en anaerobiosis, nos indica la presencia de S. agalactiae. Hay
que tener en cuenta que, aproximadamente, un 5% de los aislamientos suelen ser cepas no hemolíticas y
no pigmentadas, por lo que no serían detectadas con este medio.
Grupo mitis
S. pneumoniae
Las colonias de neumococo son características, producen alfahemólisis (por peróxido de hidrógeno) y,
si se prolonga algo la incubación de las placas, el centro de las colonias aparece ligeramente deprimido
como resultado de la autólisis
.
Objetivo de la práctica
La práctica cubre desde la obtención de una muestra de calidad (exudado faríngeo y nasal),
transporte, procesamiento hasta el reporte e interpretación de resultados (fases preanalítica,
analítica y post analítica).
Aparatos, equipos e instrumentos: microscopio óptico, mechero Bunsen, incubador 37º e incubador 37º
C, 5%-7% CO2
3. En una segunda caja bipetri con agar sangre etiquetar en la base “S. pyogenes”. En una
mitad etiquetar “optoquina” y en la segunda mitad “bacitracina”.
3.1. Repetir el proceso con S. pneumoniae en una tercera caja bipetri.
4. Realizar técnica de cultivo en “césped” en la caja de S. pneumoniae y en la de S. pyogenes.
4.1. Sumergir un hisopo estéril en la suspensión bacteriana.
4.2. Eliminar el excedente presionando el hisopo contra las paredes del tubo antes de
retirarlo.
4.3. Pasar el hisopo por el agar sangre realizando un zigzag muy cerrado. Girar 90° y volver
a realizar el procedimiento.
5. Colocar los discos de antibióticos en sus respectivas mitades.
5.1. Calentar la punta de las pinzas al rojo vivo y dejar enfriar.
5.2. Tomar con cuidado un disco de optoquina y colocarlo en la mitad del agar.
5.3. Calentar la punta de las pinzas al rojo vivo y dejar enfriar.
5.4. Tomar con cuidado un disco de bacitracina y colocarlo la mitad del agar.
5.5. Repetir el proceso con la otra caja bipetri con cultivo en césped.
6.1. Etiquetar la base de una caja Petri con agar sangre con “Nasofaríngeo” y “Orofaríngeo”.
6.2. Tomar la muestra de acuerdo a la técnica explicada
Exudado faríngeo.
El cultivo faríngeo es el método estándar para documentar la presencia de S. pyogenes en la
faringe, esta prueba alcanza una sensibilidad del 90 a 95%.
Condiciones previas del paciente
• El paciente no debe haber recibido antibióticos en los últimos 8 días, previos a la obtención de
la muestra.
• El paciente debe acudir en ayunas al laboratorio.
• Debe cepillarse los dientes y no practicar gargarismo.
Procedimiento
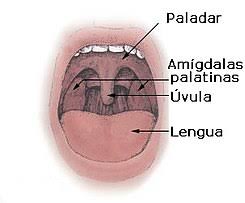
1. Inspección de la faringe: ubicar al paciente en una posición cómoda y con buena iluminación,
deprimir la lengua con el bajalenguas, visualizar la fosa amigdalina y faringe en busca de
exudado posterior, presencia de pseudomembrana o placas
2. Indicar al paciente que abra la boca y que pronuncie un largo “ah”, el cual sirve para elevar
la úvula y evitar las náuseas.
3. Introducir el hisopo y frotar enérgicamente ambas amígdalas y la pared posterior de la faringe
con movimientos de barrido.
4. Retirar el hisopo cuidando de no tocar las paredes laterales de orofaringe, úvula, lengua,
encías y dientes.
5. Extender la muestra con suaves movimientos sobre la superficie de los portaobjetos para
realizar los frotis que serán teñidos al Gram.
6. Obtener un segundo hisopado de fauces para la siembra en Agar Sangre de carnero, Girar
la cabeza del hisopo y presionar ligeramente contra una zona pequeña del extremo de la
caja Petri.
7. Estriar por agotamiento con un asa previamente esterilizada para obtener colonias aisladas.
8. Incubar el agar sangre a 37°C, en condiciones de 5-7% CO2, por 24-72 horas.
Observación: En caso de ser necesario, la muestra se podrá transportar en medio de Stuart o
Amies, realizando el cultivo de la misma en el menor tiempo posible (menos de 2 horas).
Interpretación del examen directo
Gram: describir los hallazgos de células inflamatorias, la morfología y disposición bacteriana
presente (ejemplo: cocos Gram positivos en cadena, bacilos Gram negativos fusiformes) así
mismo reportar la presencia de células levaduriformes, hifas y pseudohifas.
SESIÓN 2
1. Bipetri estriada con S. pneumoniae y S. pyogenes:
1.1. Observar las características morfológicas de las colonias.
1.2. Hemolisis de cada una de las cepas.
1.3. Realizar la prueba de catalasa de ambas cepas bacterianas.
1.4. Reportar resultados en la Tabla de características microbiológicas observadas.
2. Bipetris con discos antibióticos: interpretar resistencia y susceptibilidad a los antibióticos
optoquina y bacitracina.
2.1. Medir diámetros de los halos (si los hay).
2.2. Registrar los resultados y su interpretación (Resistente o Susceptible) en la Tabla de
respuesta a antibióticos.
3. Muestras nasofaríngea y orofaríngea:
3.1. Identificar las características morfológicas de cada una de las colonias aisladas
(escoger mínimo dos morfologías diferentes)
3.2. Realizar tinción Gram.
3.3. Realizar prueba de catalasa.
3.4. Con los datos obtenidos identifique de manera presuntiva el género y la posible especie
de las bacterias aisladas.
3.5. Registrar resultados en la Tabla de características morfológicas y microbiológicas de
muestras nasofaríngeas y orofaríngeas.
Datos a ser registrados y el método de análisis y de presentación de resultados.
Género Streptococcus: una revisión práctica para el laboratorio de microbiología
Cuestionario:
PREGUNTA 1: ¿Mediante qué mecanismo S. pneumoniae lisa los eritrocitos?
PREGUNTA 2: ¿La clasificación de Lancefield en qué está basada?
PREGUNTA 3: ¿Por qué el patrón de hemólisis es útil para clasificar estreptococos?
PREGUNTA 4: En referencia a las características generales de los Streptococcus. Señale la opción
correcta. Puede haber más de una opción correcta o ninguna. Justifique cuando
una opción es incorrecta:
a) Son cocos Gram-positivos agrupados en cadena.
b) Tienen crecimiento rápido y forman colonias al cabo de 24-36 horas de cultivo.
c) Sólo pueden oxidar los azúcares, no pueden fermentarlos.
d) Son bacterias con mínimos requerimientos nutricionales y pueden crecer en medios pobres.
e) Dan reacción positiva a la prueba de la catalasa.
f) Se las denomina fastidiosas porque las cepas con importancia médica desarrollan más
lentamente.
g) Una de las especies beta hemolíticas con mayor importancia médica es S. pneumoniae.
a) Correcta, en cadenas y en diplococos
b) Correcto. Aunque pueden aparecer cultivos tras 18 horas
c) Correcto, los bacilos son fermentadores de lactosa
d) Verdadero, se las puede cultivar en medio solidos
e) Falso. Todas las especies de Streptococcus son catalasa negativa y Staphylococcus son catalasa
positivo
f) Verdadero, S. pneumonie puede ser considerada una bacteria fastidiosa ya que tiene requerimientos
nutricionales específicos
g) La más importante Beta hemolíticos es Streptoccocus pneumoniae
PREGUNTA 5: ¿Por qué el patrón de hemólisis es útil para clasificar estreptococos?
Resultado: Porque nos permite dividir a los Streptococcus según su patrón de lisis de los eritrocitos.
Existen Streptococcus alfa hemolíticas que producen una hemólisis incompleta, existen Beta
hemolíticos que producen una hemólisis completa y los gamma hemolíticos que no producen
hemólisis,
PREGUNTA 6: En referencia a las características generales de los Streptococcus pyogenes. En todas
los casos señale la opción CORRECTA. Puede haber más de una opción correcta o ninguna. Justifique
cuando una opción es incorrecta:
a) La proteína M y las exotoxinas SpeA, SpeB y SpeC caracterizan a las cepas más patógenas.
b) Es la causa más frecuente de faringitis en niños y adolescentes de la comunidad.
c) La escarlatina es una manifestación cutánea causada por una exotoxina pirogénica.
d) Las cepas invasivas que producen SpeA pueden causar shock tóxico.
e) Causan infecciones de piel localizadas, sin diseminación a tejidos contiguos.
f) Es sensible a la bacitracina, lo que permite un reconocimiento temprano en cultivo.
g) Causa infecciones piógenas.
PREGUNTA 7: En referencia a las características generales de los Streptococcus pneumoniae. En
todas los casos señale la opción CORRECTA. Puede haber más de una opción correcta o ninguna.
Justifique cuando una opción es incorrecta:
a) Puede integrar la microbiota normal nasofaríngea e infecta a individuos de la comunidad.
b) Su reservorio exclusivo es el humano.
c) Desarrolla en agar sangre con producción de hemólisis completa.
d) La ausencia de cápsula permite su diseminación sanguínea.
e) Existen solo 2 serotipos capsulares, A y B.















No hay comentarios:
Publicar un comentario
Cada vez que lees un artículo y no dejas un comentario, alguien mata a un gatito en alguna parte del mundo...