viernes, 30 de octubre de 2020
jueves, 29 de octubre de 2020
Resultados práctica muestras de piel
La primera prueba que hicimos fue la de la catalasa. La catalasa es una enzima que proteje a las células frente al peróxido de hidrógeno producido en el metabolismo del oxígeno. Cataliza la formación de agua y oxígeno a partir del peróxido de hidrógeno. Es util para distinguir Streptococcus (negativa) de Staphylococcus (positiva).
La actividad catalasa se detecta añadiendo unas gotas de peróxido de hidrógeno sobre las colonias en placa que no sea de agar sangre (daría falsos positivos). La producción de burbujas indica la presencia del enzima. Burbujas: catalasa positivo.
La prueba de la coagulasa. La coagulasa es un enzima capaz de desnaturalizar la fibrina del plasma. Los Staphylococcus aureus patógenos dan una reacción positiva y los no patógenos negativa
Se añade una suspensión densa de bacterias a un tubo pequeña con plasma y se incuba a 37 oC. Se observa la coagulación a las 4 y 24 h sin sacarlos de la estufa.
S. aureus produce dos formas de coagulasa, una que se encuentra ligada a la membrana (coagulasa ligada, ya revisada) y otra coagulasa libre.
La coagulasa libre, a diferencia de la coagulasa ligada, no cataliza la reacción directa entre fibrinógeno y fibrina, su mecanismo de acción es modificar el factor de reacción con la coagulasa a estafilotrombina, un producto semejante a la trombina.
Estafilotrombina es el factor que cataliza la conversión de fibrinógeno a fibrina, que formará un coágulo rodeando las células de S. aureus impidiendo que las células inmunológinas del hospedador entren en contacto con la bacteria e inicien la fagocitosis.
A la izquierda tenemos a S. aureus que produjo coagulación y a la derecha tenemos a S. epidermidis que no produjo coagulación. La coagulasa reacciona con la protrombina en la sangre. El complejo resultante se llama estafilotrombina, y permite que la enzima proteasa convierta el fibrinógeno en fibrina. Esto hace que se coagule la sangre. La coagulasa está estrechamente relacionada con la superficie de la bacteria.
La siguiente prueba será la presencia de DNasa. Algunas bacterias excretan nucleasas que despolimerizan el DNA. Se hace una estría gruesa una placa conteniendo DNA. Se revela después de incubar con HCL 0,1 N que precipita el DNA no hidrolizado
Pregunta 1: ¿Por qué tiene color dorado el S. aureus? ¿Qué función tienen generalmente estos pigmentos?
El color amarillo es debido a pigmentos carotenoides. La síntesis de productos coloreados por parte de los microorganismos es una característica determinada genéticamente. Su formación en muchos microorganismos es dependiente de la presencia de la luz, composición del sustrato y la temperatura de incubación. La presencia de pigmentos en las bacterias que medran en hábitats sometidos a la luz les confieren un efecto protector frente a la luz visible y el ultravioleta cercano. Los carotenoides se localizan en la membrana plasmática y protegen a la célula de la fotooxidación, su presencia confiere a las bacterias colores que van desde el tono amarillo al rojo.Pregunta 2: Queremos distinguir S. aureus de Streptococcus pyogenes. Los crecemos en agar sangre y realizamos la prueba de la catalasa. ¿Por qué debemos tener cuidado cuando tomamos una colonia de no tomar agar sangre?
La actividad catalasa se detecta añadiendo unas gotas de peróxido de hidrógeno sobre las colonias en placa que no sea de agar sangre ya que los eritrocitos poseen catalasa, lo cual nos daría falsos positivos.
Pregunta 3: ¿Qué le pasa al ADN cuando añadimos ácido clorhídrico? ¿Qué efecto tiene la DNasa en el este efecto?
miércoles, 28 de octubre de 2020
Práctica muestras de piel
El juego de las 20 preguntas consiste en pensar que algo concreto, una cosa, persona, animal... que todo el mundo que esté jugando conozca. Las personas que jueguen tienen que adivinar qué es en menos de 20 preguntas. Las preguntas tienen que estar formuladas de manera que se pueda contestar si o no. Este juego procede del juego "Twenty questions" que se juega en los EEUU desde el SXIX. En mis clases solía jugar este juego para explicar en qué consiste la clasificación dicotómica
Una clave dicotómica se basa preguntas sobre la presencia o no de caracteres morfológicos, de estructura, composición química... De esta pregunta parten dos soluciones posibles, en función de si tienen o no tienen determinado carácter. Las mejores preguntas son las que dividen el grupo en dos subgrupos más o menos 50% y 50%. De esa manera, a base de repetir el proceso de preguntas que dividen al grupo en subgrupos 50% y 50% podemos llegar a definir cualquier organismo vivo.
Las enfermedades causadas por S. aureus se dividen en enfermedades piógenas localizadas o "productoras de pus" que se caracterizan por la destrucción de tejidos mediada por enzimas hidrolíticas y citotoxinas; y las enfermedades mediadas por toxinas que funcionan como superantígenos que producen enfermedades sistémicas. S. aureus, el patógeno estafilocócico clínicamente más significativo, puede causar infecciones de piel, heridas, tejido óseo, síndrome de la piel escaldada, shock tóxico e intoxicación alimentaria.
Caja Tripetri con Agar Sangre Humana (ASH)
viernes, 16 de octubre de 2020
jueves, 15 de octubre de 2020
¿Por qué meter con calzador una especie donde no pertenece?
La enfermedad de una plantita suele ser un indicativo de que la planta no está donde debiera
Quizas por exceso de sol, exceso de cáscaras de huevo, que con la mejor intención se le añadió a su maceta con la esperanza de que el calcio y los restos de proteínas la hiciesen crecer mejor. Nada de esto sirvió para que creciese más de lo esperado. Las hojas se recurvaron quizás por un virus o por un hongo. Le aparecieron chinches y se le cepilló para eliminarlos a mano, se lavaron sus hojas con vinagre. La planta no tiene un aspecto saludable, aunque últimamente le han salido unas florecillas con lo que es de suponer que no está tan tan mal del todo.miércoles, 14 de octubre de 2020
Siembra, aislamiento y caracterización de bacterias
Las bacterias son pequeñas células procariotas, cuya longitud es de 0.2 a 10 μm.
La clasificación preliminar de bacterias se basa en la forma (cocos, bacilo y espirilos), disposición (pares, cadenas o grupos), propiedades específicas de crecimiento (aerobias o anaerobias, anaerobios facultativos)
resistente al ácido. Los micoplasmas son bacterias que no tienen pared celular y, por lo tanto, no se tiñen con Gram. Algunos tipos de bacterias pueden generar esporas.
1. De manera individual inocular en medio sólido en caja Petri a partir del caldo de
cultivo.
a. Esterilizar el asa redonda al rojo vivo en la llama azul del mechero Bunsen.
Todas las transferencias y siembras se deben ejecutar a partir de este proceso
y permanecer cerca de la zona de esterilidad del mechero.
b. Antes y después de abrir un tubo se debe flamear el borde o la boca rosca. Para
disminuir contaminaciones, se recomienda sujetar la tapa con el dedo meñique,
no dejarla sobre el mesón de trabajo.
c. Enfriar el asa en las paredes internas del tubo previo a tomar la muestra líquida.
Tener precaución de no producir aerosoles.
d. Tomar una muestra homogénea, observar que se forme una película de líquido
en la cabeza del asa redonda.
e. Flamear por última vez la boca del tubo y tapar.
f. Realizar el inóculo primario sobre el borde del agar contenido en la caja Petri y
proceder con la siembra semicuantitativa por la técnica de agotamiento.
g. Finalmente esterilizar el asa redonda, tapar la caja Petri y rotular sobre la base
de la caja.
2. Por equipo de trabajo, inocular en medios en tubo a partir de un medio sólido en
caja Petri
a. Colocar la caja Petri cerca del mechero Bunsen con la tapa hacia abajo.
b. Esterilizar el asa recta al rojo vivo en la llama azul del mechero Bunsen.
c. Destapar la caja Petri y enfriar el asa recta en una zona del agar libre de
crecimiento. Tener precaución de no producir aerosoles.
d. Tomar una muestra a partir de una colonia claramente aislada y definida. Tapar
la caja en seguida.
e. Destapar el tubo donde se inoculará. Sujetar la tapa con el dedo meñique.
f. Flamear la boca del tubo de vidrio no inoculado.
3 mm antes de llegar al fondo, retirar lentamente y estriar en la superficie de lado
a lado.
manera vertical y precisa hasta 3 mm antes de llegar al fondo, retirar lentamente
i. Flamear por última vez la boca del tubo y tapar.
j. Finalmente esterilizar el asa recta, y rotular el tubo.
Inocular en medio líquido a partir del caldo de cultivo (realizar 1 de las 3 técnicas):
Inoculación con asa redonda:
a. Destapar y flamear el tubo de donde se tomará la muestra.
b. Tomar la muestra con el asa redonda previamente esterilizada, flamear y tapar
enseguida el tubo.
c. Abrir el tubo no inoculado y flamear la boca, inclinarlo y depositar suavemente el
líquido contenido en la cabeza del asa redonda contra la superficie del medio.
d. Flamear y tapar enseguida el tubo inoculado, rotular.
Inocular con hisopo:
a. Introducir el hisopo en el medio con muestra bacteriana y agitar, llevar el hisopo
al tubo no inoculado y rotar.
b. Para desechar el hisopo en cortopunzantes previamente flamear la parte
contaminada del hisopo.
Inocular con pipeta:
a. Aspirar con la pipeta Pasteur un pequeño volumen de la muestra bacteriana
previamente homogenizada y transferir inmediatamente al tubo no inoculado,
mezclar nuevamente.
b. Desechar la pipeta en el recipiente con hipoclorito de sodio al 0.5%. Flamear y
tapar enseguida el tubo inoculado, rotular.
SESIÓN 2
1. Seleccionar 1 caja petri (de las inoculadas individualmente) por equipo de trabajo y
realizar tinción Gram de 1 colonia aislada.
2 Completar la tabla a continuación en relación con las características morfológicas y
microscópicas de las colonias bacterianas aisladas
Resultado: 1/500 x 1/100 x 1/10 x 1/20 x 1/50 = 0,000000002
2.5 x 109 x 1/500 x 1/100 x 1/10 x 1/20 x 1/50 = 5 colonias
martes, 13 de octubre de 2020
Cómo tomar muestras para el laboratorio de microbiología
Para tomar una muestra debemos tener en cuenta lo siguiente:
• Seleccionar adecuadamente el sitio anatómico de donde se obtendrá la muestra.
• Tomar la muestra utilizando la técnica adecuada.
• Colocar la muestra en un recipiente adecuado.
• Transportar la muestra al laboratorio lo más rápido posible.
• De ser necesario, almacenar los especímenes adecuadamente.
Urocultivos
En un urocultivo se considera una bacteriuria como "significativa" o lo que es lo mismo una infección urinaria si se recuentan más de 100.000 UFC/ml de orina. Es lo que se conoce como criterio de Kass.
Fusobacterium se adhiere a los azúcares de las células cancerosas
La bacteria Fusobacterium nucleatum pertenece a las bacterias Gram negativas, anaerobias y de aspecto filamentoso tiene un tropismo hacia la glucoproteína superficial Gal/GalNAc que se encuentra en algunas células cancerosas
https://www.investigacionyciencia.es/noticias/nuevo-actor-en-la-metstasis-19104
Kapatral, V.; Anderson, I.; Ivanova, N.; Reznik, G.; Los, T.; Lykidis, A.; Bhattacharyya, A.; Bartman, A.; Gardner, W.; Grechkin, G.; Zhu, L.; Vasieva, O.; Chu, L.; Kogan, Y.; Chaga, O.; Goltsman, E.; Bernal, A.; Larsen, N.; D'Souza, M.; Walunas, T.; Pusch, G.; Haselkorn, R.; Fonstein, M.; Kyrpides, N.; Overbeek, R. (2002). «Genome Sequence and Analysis of the Oral Bacterium Fusobacterium nucleatum Strain ATCC 25586». Journal of Bacteriology 184 (7): 2005-18. PMID 11889109. doi:10.1128/JB.184.7.2005-2018.2002.
«Fusobacterium nucleatum in Periodontal Health and Disease». Current Issues in Molecular Biology. 2011. doi:10.21775/cimb.013.025.
Mor, Gil; Kwon, Ja-Young (2015). «Trophoblast-microbiome interaction: a new paradigm on immune regulation». American Journal of Obstetrics and Gynecology 213 (4): S131-7. doi:10.1016/j.ajog.2015.06.039.
Todar, K. «Pathogenic E. coli». En University of Wisconsin–Madison Department of Bacteriology, ed. Online Textbook of Bacteriology. Consultado el 30 de noviembre de 2007.
Han, Y. W.; Redline, R. W.; Li, M.; Yin, L.; Hill, G. B.; McCormick, T. S. (2004). «Fusobacterium nucleatum Induces Premature and Term Stillbirths in Pregnant Mice: Implication of Oral Bacteria in Preterm Birth». Infection and Immunity 72 (4): 2272-9. PMID 15039352. doi:10.1128/IAI.72.4.2272-2279.2004.
Hillier SL, Krohn MA, Rabe LK, Klebanoff SJ, Eschenbach DA (1993). «The normal vaginal flora, H2O2-producing lactobacilli, and bacterial vaginosis in pregnant women». Clinical Infectious Diseases. 16 Suppl 4: S273-81. PMID 8324131.
Hitti J, Hillier SL, Agnew KJ, Krohn MA, Reisner DP, Eschenbach DA (2001). «Vaginal indicators of amniotic fluid infection in preterm labor». Obstetrics and Gynecology 97 (2): 211-9. PMID 11165584.
Kostic, Aleksandar D.; Chun, Eunyoung; Robertson, Lauren; Glickman, Jonathan N.; Gallini, Carey Ann; Michaud, Monia; Clancy, Thomas E.; Chung, Daniel C.; Lochhead, Paul; Hold, Georgina L.; El-Omar, Emad M.; Brenner, Dean; Fuchs, Charles S.; Meyerson, Matthew; Garrett, Wendy S. (2013). «Fusobacterium nucleatum Potentiates Intestinal Tumorigenesis and Modulates the Tumor-Immune Microenvironment». Cell Host & Microbe 14 (2): 207-15. doi:10.1016/j.chom.2013.07.007.
jueves, 8 de octubre de 2020
Tinción de Ziehl-Neelsen
El diagnóstico definitivo de las enfermedades infecciosas causadas por micobacterias se basa en la demostración de su agente etiológico. Esto se consigue, entre otras formas, por histopatología, mediante la tinción bacilos ácido alcohol resistentes (BAAR) en los tejidos obtenidos in vivo o en la autopsia. La Tinción de Ziehl-Neelsen sirve para teñir Nocardias y Mycobacterium, bacterias con una cubierta cerosa.
PREGUNTA 2: En el protocolo dice que hay que dejar el alcohol ácido sobre el portaobjetos de 1 a 2 minutos. Si no se da el tiempo suficiente de decoloración ¿Qué ocurre?
miércoles, 7 de octubre de 2020
Tinción de Giemsa: teñir tejidos y células sanguíneas
Diferenciar las eubacterias en dos bloques: tinción de Gram
Clave dicotómica: aprender a discriminar
El juego de las 20 preguntas consiste en pensar que algo concreto, una cosa, persona, animal... que todo el mundo que esté jugando conozca. Las personas que jueguen tienen que adivinar qué es en menos de 20 preguntas. Las preguntas tienen que estar formuladas de manera que se pueda contestar si o no. Este juego procede del juego "Twenty questions" que se juega en los EEUU desde el SXIX.
En mis clases solía jugar este juego para explicar en qué consiste la clasificación dicotómica
Una clave dicotómica se basa preguntas sobre la presencia o no de caracteres morfológicos, de estructura, composición química... De esta pregunta parten dos soluciones posibles, en función de si tienen o no tienen determinado carácter. Las mejores preguntas son las que dividen el grupo en dos subgrupos más o menos 50% y 50%. De esa manera, a base de repetir el proceso de preguntas que dividen al grupo en subgrupos 50% y 50% podemos llegar a definir cualquier organismo vivo.
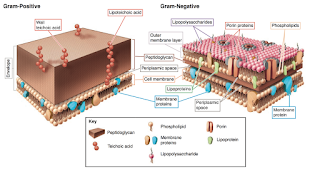
Según la distribución del peptidoglicano de la pared celular que las envuelve, se tiñen de una forma u otra, lo que permite diferenciar las bacterias en dos bloques: Bacterias Gram positivas y las Gram negativas, de gran utilidad para elegir un determinado tratamiento antibiótico.
Así, las bacterias que no se tiñen mediante esta técnica se denominan Gram negativas. Están formadas por una pared más fina formada por menos capas de peptidoglicano y una segunda membrana rica en lípidos (que repele la tinción Gram), al microscopio aparecen incoloras. La belleza de está técnica radica en que las eubacterias se dividen en Gram positivas y Gram negativas, es decir, lo que discrimina esta técnica de tinción son los dos grandes grupos en los que se dividen las eubacterias.
Las Gram positivas suelen ser cocos, es decir, bacterias esféricas debido a su mayor turgencia (presión interna) y las Gram negativas bacilos, es decir, con forma de bastones
¿Cómo teñir?
El cristal violeta se une a la pared bacteriana y se estabiliza con el lugol. La mezcla alcohol-acetona disuelve la membrana externa de las bacterias Gram negativas (más fina que la de las Gram positivas) extrayéndose el cristal violeta. Después se tiñen solo las Gram negativas con safranina.
Pasos para realizar la tinción Gram
1 Tomamos bacterias con el asa y las diluímos en una gota de agua sobre el portaobjetos. Dejamos secar
2 Gota de violeta cristal durante 1 min.
3 Lavamos con agua
4 Gota de lugol (yodo) durante 1 min.
5 Lavamos con agua
6 Lavamos con alcohol 5-10 seg.
7 Lavamos con agua
8 Gota de safranina durante 1 min.
9 Lavamos con agua y secamos. Ponemos un cubreobjetos y al microscopio.
La pared celular, clave en la tinción de Gram
La pared celular tiene que estar entrelazada para que sea una malla efectiva e impida que la célula explote debido a su turgencia o presión interna.
La penicilina impide que la pared celular forme una malla y eso provoca que la célula literalmente explote.
PREGUNTA 2: ¿Qué ocurre cuando usamos el objetivo de 100X y no usamos aceite de inmersión?
https://learn.chm.msu.edu/vibl/content/gramstain.html
https://virtuallab.tlc.ontariotechu.ca/intro.php
Laboratorio virtual – AMRITA
No corre en Chrome, hay que descargar el navegador Firefox y descargar Adobe Flash Player.
Tiene simulaciones de casi todo, pero no es interactivo
Lab virtual de micro 1: https://vlab.amrita.edu/index.php?sub=3&brch=73
Lab virtual de micro 2: https://vlab.amrita.edu/index.php?sub=3&brch=76