Las relaciones entre individuos se pueden resumir, como hemos visto, en competitivas, parasíticas y simbióticas. Las relaciones competitivas nos son fáciles de entender. Se basan en el egoísmo, "quítate tu pa ponerme yo". Adam Smith, intuyó que entender el interés personal de un compañero podría llegar a un intercambio mútuamente beneficioso bajo la premisa "dame lo que necesito y tendrás lo que deseas". Es decir, las relaciones competitivas no solo generan egoísmo en las relaciones. Las relaciones parasíticas tampoco es una depredación de recursos y una manipulación sin nada a cambio, en muchos casos. Estamos empenzando a entender estos procesos. En la simbiosis parece que se llega a una relación perfecta donde tu ganas y yo gano... Pero, no se llega a esta situación que en principio parece ideal de una manera cooperativa, altruísta, equilibrada. Un amarre ferreo sella el destino de ambos. Sin este amarre no hay posibilidad de un destino compartido. Ese amarre molecular "o mía o de nadie" lo inventaron los virus con los sistemas toxina-antitoxina.
O mía o de nadie
El egoísmo, la extrema hijoputez, es ligar un territorio a ti de manera indisoluble. El machista quiere que su mujer le pertenezca de manera que la única forma de librarse de ellos sea con los pies por delante. O la madre posesiva que prefiere ver a su hija muerta antes que de otro. Los virus inventaron este egoísmo de una manera elegante. En su genoma llevan dos genes: uno codifica para una toxina, o un veneno, como quiera decirse. El otro gen es un antídoto que anula la actividad tóxica del veneno. El truco está en que la molécula del antídoto es lábil, es decir, se deteriora rápidamente. Tiene que estar produciéndose constantemente para anular a la toxina.
Fig. 1. Si una bacteria es portadora de ADN vírico egoísta, compuesto de un gen de toxina y otro antídoto, va a producir toxina y su antídoto. Si, al dividirse la bacteria, una hija (b) lleva el ADN vírico egoísta va a seguir produciendo toxina y antídoto, con lo cual la bacteria puede vivir su vida tranquilamente (d). Si al dividirse una de las hijas (c) carece de ese ADN vírico no va a poder producir nuevas toxinas y lo que es más importante: nuevos antídotos. Como el antídoto es una molécula lábil, de vida media corta, cuando desaparece la toxina todavía está en el interior de la célula y la mata. De esta manera se consuma el "o mía o de nadie".
Aquí hay un concepto importante que es el de los incentivos que tienen ambas partes para participar en la simbiosis. Algo que recuerda a la teoría de juegos
Cautivos del mal
En la película "Cautivos del mal" de Vicente Minelli, y guión de Charles Schnee, el personaje del productor Shields es un manipulador sin escrúpulos para quien lo esencial es el producto artístico final, tal como él lo concibe, aunque para conseguirlo deba apropiarse de ideas ajenas y rechazar la participación del que parecía su mejor amigo, enamorar a una actriz con la autoestima baja y demasiado pendiente de la botella o alejar (con desastrosas consecuencias) a la entrometida esposa de su exitoso guionista. A pesar del resentimiento frente a Shields tanto el director, como la actriz o el guionistas reconocen que nunca hubiesen alcanzado la fama si no hubiese sido por las malas artes del productor.En la película "Cautivos del mal" de Vicente Minelli, y guión de Charles Schnee, el personaje del productor Shields es un manipulador sin escrúpulos para quien lo esencial es el producto artístico final, tal como él lo concibe, aunque para conseguirlo deba apropiarse de ideas ajenas y rechazar la participación del que parecía su mejor amigo, enamorar a una actriz con la autoestima baja y demasiado pendiente de la botella o alejar (con desastrosas consecuencias) a la entrometida esposa de su exitoso guionista. A pesar del resentimiento frente a Shields tanto el director, como la actriz o el guionistas reconocen que nunca hubiesen alcanzado la fama si no hubiese sido por las malas artes del productor.
Lo que no te mata te hace más fuerte: la viruela dio una ventaja competitiva a los europeos
La viruela y el sarampión fueron una ventaja evolutiva que permitió el éxito y la expansión europea en América. Según el antropólogo Jared Diamond, Pizarro contó con una ayuda microscópica en la batalla de Cajamarca contra fuerzas incas que los superaban en un ratio de 1:50. Según publica en su libro "Gérmenes, armas y acero" el sarampión y la viruela ya habían causado pánico y estragos en la población previamente a la batalla.
¿Por qué los incas eran tan susceptibles a la viruela? La viruela originalmente es un virus de vaca. Cuando las poblaciones de Eurasia comenzaron a domesticar la vaca, el virus comenzó a infectar a las poblaciones humanas. La mayor parte de los europeos que llegaron a América tuvieron los virus en la etapa infantil y pudieron pasar las viriasis en esa etapa, por lo que ya disponían de inmunidad natural protectora. En el caso de los indígenas, la falta de contacto previo supuso una ‘virginidad inmunológica’, una falta de respuesta defensiva frente a las nuevas infecciones y por eso, al infectarse de adultos la mortalidad era tan alta.
Los virus le dan una ventaja competitiva a Pseudomonas aeruginosa
Pseudomonas en principio era una bacteria medioambiental. Vive en todo tipo de lugares, desde piscinas y spas hasta en el jabón desinfectante de hospitales. Por su extraordinaria capacidad metabólica pudo crecer en los ambientes limpios de los hospitales. Al ser los hospitales ambientes en los que los antibióticos están siempre presentes, con el tiempo se seleccionaron cepas resistentes a los antibióticos. Hoy en día, esta bacteria es la principal responsable de las infecciones adquiridas en los hospitales. Recientemente hemos aprendido de que, lo mismo que Pizarro se benefició de su historia evolutiva previa, Pseudomonas también se beneficia de un bacteriófago que antiguamente la parasitaba. Este virus bacteriofago (fago) engaña al sistema inmunitario para que este ignore a la bacteria.
Con los fagos ocurre lo mismo que con el virus del herpes labial que vive insertado en el ADN de nuestras neuronas. Sólo cuando detectan que su hospedador está estresado es cuando deciden salir de la célula que lo alberga. En el caso de los fagos rompiendo desde dentro a la bacteria, en el caso de las neuronas viajando desde el núcleo de la neurona por todo el axón hasta llegar a las células del labio en donde causa un sarpullido lleno de virus que le permite transmitirse a otro hospedador por un beso, un vaso compartido etc.
Pseudomonas en principio era una bacteria medioambiental. Vive en todo tipo de lugares, desde piscinas y spas hasta en el jabón desinfectante de hospitales. Por su extraordinaria capacidad metabólica pudo crecer en los ambientes limpios de los hospitales. Al ser los hospitales ambientes en los que los antibióticos están siempre presentes, con el tiempo se seleccionaron cepas resistentes a los antibióticos. Hoy en día, esta bacteria es la principal responsable de las infecciones adquiridas en los hospitales. Recientemente hemos aprendido de que, lo mismo que Pizarro se benefició de su historia evolutiva previa, Pseudomonas también se beneficia de un bacteriófago que antiguamente la parasitaba. Este virus bacteriofago (fago) engaña al sistema inmunitario para que este ignore a la bacteria.
Video 1: Ciclo del virus del herpes
Con los fagos ocurre lo mismo que con el virus del herpes labial que vive insertado en el ADN de nuestras neuronas. Sólo cuando detectan que su hospedador está estresado es cuando deciden salir de la célula que lo alberga. En el caso de los fagos rompiendo desde dentro a la bacteria, en el caso de las neuronas viajando desde el núcleo de la neurona por todo el axón hasta llegar a las células del labio en donde causa un sarpullido lleno de virus que le permite transmitirse a otro hospedador por un beso, un vaso compartido etc.
Video 2: Diferencia entre fagos líticos (los que destruyen a las bacterias) y los lisogénicos (que pueden insertar temporalmente su ADN en el ADN de la bacteria hospedadora). Fuente
La bacteria y el fago, llamado Pf, establecen una relación de simbiosis que se sospecha que está más extendida en el mundo microbiano de lo que se creía. Pseudomonas crece en las heridas abiertas de los pacientes de los hospitales. Las Pseudomonas que no tienen en su interior fagos sobreviven menos que aquellas Pseudomonas que si los tienen porque cuando el fago detecta que el sistema inmune ataca a Pseudomonas sale de entre el ADN de la bacteria, hace muchas copias de si mismo, mata a la bacteria y sale por decenas al cuerpo del paciente. Esto hace que el sistema inmunitario se dedique a matar fagos dándole un respiro a las bacterias que pueden seguir colonizando la herida abierta aunque tengan que pagar el peaje de que muchas de ellas revienten por culpa de la proliferación de los fagos.
El fago "distrae" al sistema inmune como un señuelo. De esa manera, dejan de acosar a la bacteria que es el hospedador del fago. Este hallazgo ha sido publicado el pasado 28 de marzo en Science y ayudaría a explicar por qué el sistema inmunitario tolera las bacterias beneficiosas, como las presentes en el intestino, y podría guiar el diseño de mejores tratamientos para las infecciones.
Heridas abiertas infectadas por bacterias cautivas del mal
Para comprobar si los fagos influyen en el modo en el que las bacterias interactúan con sus huéspedes, el inmunólogo Paul Bollyky, de la Universidad Stanford, recogió muestras de heridas crónicas, como quemaduras infectadas, de 111 personas. De estas muestras, 37 presentaban infección por P. aeruginosa.
Bollyky y sus colaboradores encontraron que el 68 por ciento de las heridas que contenían P. aeruginosa albergaban también el virus Pf. Cuando transfirieron estas bacterias infectadas por el fago a heridas abiertas de ratones, descubrieron que el número de bacterias necesario para iniciar la infección en los roedores era menor y que estos eran más propensos a morir a causa de esas heridas que cuando eran infectados únicamente con la bacteria P. aeruginosa.
Para comprobar si los fagos influyen en el modo en el que las bacterias interactúan con sus huéspedes, el inmunólogo Paul Bollyky, de la Universidad Stanford, recogió muestras de heridas crónicas, como quemaduras infectadas, de 111 personas. De estas muestras, 37 presentaban infección por P. aeruginosa.
Bollyky y sus colaboradores encontraron que el 68 por ciento de las heridas que contenían P. aeruginosa albergaban también el virus Pf. Cuando transfirieron estas bacterias infectadas por el fago a heridas abiertas de ratones, descubrieron que el número de bacterias necesario para iniciar la infección en los roedores era menor y que estos eran más propensos a morir a causa de esas heridas que cuando eran infectados únicamente con la bacteria P. aeruginosa.
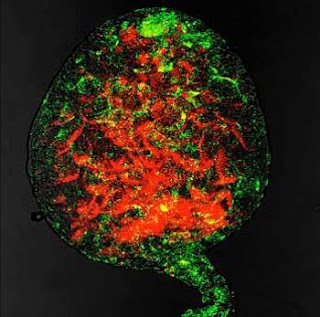
Fig. 4. Internalización del fago Pf en una célula de mamífero. La endocitosis de Pf por las células dendríticas y otros leucocitos dispara los receptores de reconocimiento viral, los cuales suprimen la limpieza y eliminación de las bacterias. Esta imagen tridimensional fue generada utilizando microscopía confocal y imágenes apiladas en Z. Púrpura tiñe las fibras de actina, azul el ADN mediante DAPI, el verde es el fluoróforo Alexa Fluor 488 unido a un anticuerpo antiPf4. Fuente
Las bacterias atraían a unas células del sistema inmunitario llamadas fagocitos, los cuales «engullen» a las bacterias pero no a los virus. Los fagocitos intervenían en las heridas infectadas por P. aeuruginosa y Pf y se marchaban poco después de haber engullido unas pocas bacterias. Luego envíaban señales que atraín a otras células del sistema inmunitario encargadas de atacar solo a los virus del área.
Fig. 5. Se logró reducir las infecciones causadas por P. aeuruginosa mediante la vacunación de los ratones contra los Pf, antes de infectarlos con la combinación de bacteria y virus.
Las bacterias que no amaban a los machos
Wolbachia es maestra en el arte de manipular el sexo de las especies que parasita porque necesita a las hembras para perpetuarse. Wolbachia vive dentro de las células de su hospedador de las que nunca sale. ¿Cómo hace para perpetuarse e infectar a otros individuos? Wolbachia ha resuelto este problema infectando los óvulos de las hembras. De esta manera se transmite a los descendientes de las hembras. Los machos son para ella un callejón sin salida porque al ser el espermatozoide tan pequeño no pueden introducirse en el para viajar de los machos a las hembras. Solución: fuera machos. Para eliminar a los machos esta gran manipuladora puede utilizar diferentes estrategias: la más común y más estudiada es la incompatibilidad citoplasmática, que hace que un macho infectado por Wolbachia sólo puede tener descendencia con hembras infectadas (Ver próxima entrada); algunos tipos de Wolbachia feminizan a los machos modificando sus niveles de hormonas de forma que puedan poner huevos; otra estrategia utilizada es matar a los machos cuando estos están en fase de embrión; y por último la partenogénesis en donde la hembra tiene hijos sin necesidad del esperma de un macho.
Los parásitos como Wolbachia encuentran siempre su propio camino para entender la biología de su hospedado y hacer que obedezcan sus órdenes. Es más fácil vivir dentro del cuerpo de un invertebrado que en el cambiante mundo exterior. Los organismos superiores somos más predecibles, sobre todo en cuestión de sexo y por ello más manipulables.
Fig. 2. Fotografía de microscopía de fluorescencia de Wolbachia (verde) en el interior de los testículos de un insecto. En rojo se muestra el esperma. Cortesía Michael Clark y Seth Bordenstein. Las bacterias Wolbachia viven en el interior de las células de los invertebrados infectados, también en el interior de los óvulos de las hembras. En los machos viven también en el interior de los testículos, pero son incapaces de introducirse en el interior de los espermatozoides. De esta manera las hembras infectadas transmiten la bacteria a sus hijos por lo que la bacteria favorece que haya el mayor número de hembras a expensas de los machos que para Wolbachia son un callejón sin salida
Fig. 3. Incompatibilidad citoplasmática. La toxina que produce Wolbachia deforma el ADN de los espermatozoides. Al mismo tiempo en los óvulos secreta un antídoto que corrige esta deformidad. Por eso un macho infectado por Wolbachia sólo puede tener descendencia con una hembra infectada.
Fig. 4. Feminización. En algunas especies de Wolbachia permite que nazcan machos, pero altera sus hormonas de manera que los feminiza y los hace capaces de producir huevos.
Fig. 5. Feminazización. Algunas especies de Wolbachia son capaces de matar a los embriones machos
Fig. 6. Wolbachia es capaz de alterar el estado hormonal de las hembras de manera que los huevos se convierten en embriones sin necesidad del esperma del macho. Todos los embriones fecundados sin esperma se convierten en hembras, las cuales también pueden dar procrear sólo hembras.
Gracias a herramientas como ésta, Wolbachia manipula las poblaciones de sus hospedadores, de manera que en vez de tener poblaciones en donde la mitad son machos y la otra mitad hembras resulta que por cada 99 hembras hay un solo macho. Obviamente cuando se llega a esos extremos las hembras viven una situación de intensa competencia por los machos que como podemos imaginar viven acosados y extenuados.
La carrera de armamentos de Wolbachia y sus hospedadores
El investigador Greg Hurst del University College de Londres descubrió que la mariposa Hypolimnas bolina la cual tenía una relación de 99 hembras por cada macho, en los años 2005 al 2006 cambió esta relación a la de 60 hembras por cada 40 machos. Este cambio se produjo en solo 10 generaciones debido a una variante genética que hacía que la toxina de Wolbachia no funcionase. Obviamente las mariposas sin Wolbachia se reprodujeron más y mejor reestableciendo el equilibrio entre sexos. Este fue un caso claro de evolución en acción en un espacio de tiempo reducido.
Wolbachia como barrera intraespecífica
Las especies como matriuskas rusas: un saltamontes colonizado por una bacteria que vive dentro de sus células. Esta bacteria, a su vez contiene a su vez un virus. El virus le proporciona a la bacteria herramientas moleculares para que la bacteria se mantenga en la Especies como matrioskas rusaspoblación de saltamontes. De esta manera en un ejemplar de saltamontes infectado tendremos al saltamontes, la bacteria y el virus todo en uno. Pero aun hay más. Recientemente el grupo de McMeniman de la Universidad de Queensland ha conseguido infectar mosquitos transmisores del virus del Dengue con Wolbachia, otros grupos han descubierto que el gusano que causa la filariasis, una enfermedad tropical que afecta a 120 millones de personas, está a su vez infectado con la bacteria Wolbachia, y que si matan a la bacteria con un antibiótico, el gusano por si mismo no puede sobrevivir. De esta manera están administrando antibiótico a los enfermos de filariasis como tratamiento coadyuvante con éxito. Todo esto nos indica que a este sistema de tres bandas: virus, bacteria e invertebrado hay que añadir ahora un nivel más de complejidad, la tecnología que empleará la bacteria para mejorar la salud de otra especie, la nuestra.
El parasitismo de Wolbachia podría ser una explicación del porqué existen tantas especies distintas de insectos. Imaginemos que en vez de infectar invertebrados Wolbachia infectase personas. Imaginemos que una cepa de Wolbachia, llamémosla A, infecta a franceses, mientras que en España, una cepa B infecta españoles. Si el antídoto de la cepa A no funciona para la toxina de la cepa B y viceversa ¿Qué ocurriría? el resultado sería que los españoles no podríamos tener hijos con franceses ni los franceses con españoles. Esto convertiría técnicamente a españoles y franceses en especies distintas. Si eliminásemos las bacterias con un antibiótico entonces todo volvería a se como antes.
Esto mismo fue lo que hizo el investigador Jack Werren de la Universidad de Rochester con las avispas Nasonia. En la avispa Nasonia hay poblaciones que están colonizadas por una clase de Wolbachia que llamaremos cepa A, y otra población colonizada por la cepa B. Jack Werren observó que si intentaba aparear Nasonia portadora de la cepa A con Nasonia portadora de la cepa B, los embriones resultantes eran inviables. Esto es así por que el antídoto que produce la cepa A sólo corrige los defectos en el esperma de los machos colonizados con la cepa A, y lo mismo ocurre en las avispas colonizadas por la cepa B. Cuando Jack Werren trató las avispas con un antibiótico que eliminó las bacterias, entonces fue posible tener embriones viables cuando se apareaban las dos poblaciones de avispas colonizadas por cepas distintas de Wolbachia. Esto quiere decir que cuando la avispa Nasonia estaba colonizada con dos cepas distintas de Wolbachia cada población era una especie diferente ya que no podían cruzarse entre si. Pero si ambas poblaciones están libres de la bacteria, o las bacterias son eliminadas de la población de avispas con un antibiótico en este caso no hay barreras para el apareamiento entre ambas poblaciones.
Especies como matrioskas rusas
Fig. 7. La ceguera de los ríos es la segunda causa de ceguera infecciosa en todo el mundo. Se transmite a los seres humanos por medio de la picadura de las moscas negras infectadas con el gusano parásito Onchocerca volvulus, que a su vez, tiene a la bacteria endosimbionte Wolbachia viviendo en sus genitales.
Hasta ahora se pensaba que la enfermedad estaba causada por gusanos parásitos que construyen túneles en la piel y liberan millones de larvas que se distribuyen por todo el cuerpo hasta provocar una reacción inmune que conlleva la inflamación de los ojos y, posteriormente, ceguera. Parece ser que no son los parásitos los culpables sino la bacteria Wolbachia que vive en ellos. De hecho, es la responsable de la inflamación que acaba en ceguera y provoca además graves problemas en la piel. Si es una bacteria la responsable entonces podemos tratar esta enfermedad con antibióticos.










No hay comentarios:
Publicar un comentario
Cada vez que lees un artículo y no dejas un comentario, alguien mata a un gatito en alguna parte del mundo...